 Stimulation cérébrale profonde dans le traitement de la maladie de Parkinson
Stimulation cérébrale profonde dans le traitement de la maladie de Parkinson
VI. Acte chirurgical
*a. Un objectif
L’objectif de la SCP est de placer les électrodes thérapeutiques dans le noyau cible en s’assurant d’une bonne corrélation entre les données cliniques, anatomiques et électrophysiologiques et en repérant d’éventuels effets secondaires en fonction de la position des contacts thérapeutiques.
*b. Déroulement de l’hospitalisation en neurochirurgie
Une hospitalisation d’environ 10 à 15 jours est nécessaire dans le service de neurochirurgie. Comme pour toute hospitalisation dans le service de neurochirurgie, le patient devant bénéficier d’une SCP rentrera la veille de son intervention vers 15h. Ce temps permettra la visite du neurochirurgien, pour rappeler les modalités pratiques de la procédure, renouveler l’examen neurologique du patient etc., la visite pré-anesthésique et le début de la préparation du patient.
Préparation pré opératoire : la majorité des équipes réalise un rasage complet du chef (dans le but non démontré de diminution du risque infectieux) et shampoing / douche à la Bétadine rouge (dans le but de limiter les risque infectieux). Dans le cas particulier de la Maladie de Parkinson, la médication anti parkinsonienne sera arrêtée totalement à partir de minuit. Il est à noter que le patient aura bénéficié d’une consultation auprès du neurologue spécialisé dans le traitement des mouvements anormaux quelques semaines avant la chirurgie. Celui-ci aura adapté le traitement pharmacologique en substituant tous médicament dopaminergique ou agoniste de longue demi-vie par de la L-Dopa de courte demi-vie (le patient ne doit pas se présenter avec une forme LP de sa dopathérapie en particulier).
*c. Généralités
Les deux électrodes mises dans les mêmes conditions par voie stéréotaxique. Ces dernières sont ensuite reliées à un neuropacemaker permettant les réglages précis des paramètres de stimulation mais également servant de générateur pour la stimulation électrique.
Les équipes chirurgicales peuvent employer divers moyens techniques pour arriver à l’objectif thérapeutique.
La quasi-totalité des équipes utilisent un cadre de stéréotaxie pour créer leur espace stéréotaxique, certaines utiliseront en plus un robot stéréotaxique.
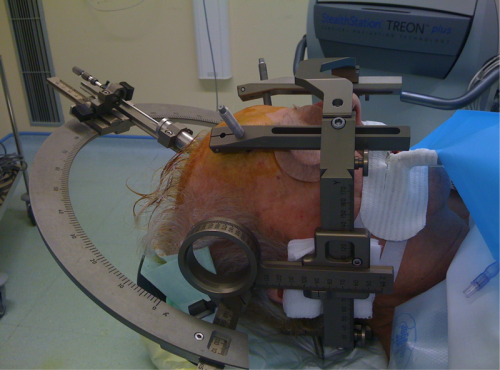
Le cadre de stéréotaxie (Leksell®) est illustré ici avec son arc (gauche) ainsi que le robot stéréotaxique (Rosa® - à droite).
La grande majorité des équipes chirurgicales utilisent plusieurs moyens d’imageries pour définir au mieux la cible (téléradiographie, scanner, IRM). Toutes utiliseront un moyen de contrôle per opératoire pour s’assurer du bon positionnement de l’électrode (amplificateur de brillance, téléradiographie, scanner peropératoire, etc.)
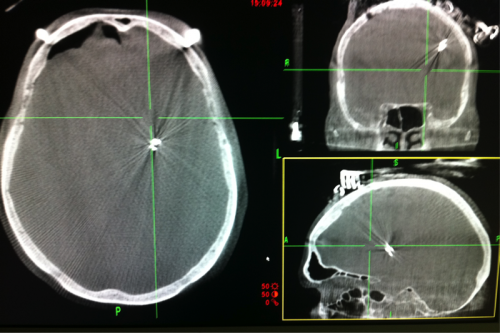
Exemple de contrôle per opératoire avec un contrôle scanner (O’arm®) et avec une téléradiographie. Avec un amplificateur de brillance, on peut visualiser les électrodes mais on ne peut mesurer l’erreur de positions des microélectrodes contrairement aux 2 autres moyens d’imagerie.
De la même manière, en France, la majorité des équipes réalisent un enregistrement électrophysiologique per opératoire et un examen clinique per opératoire pour s’assurer du bon positionnement de l’électrode. En effet, les structures profondes du cerveau (noyaux gris centraux) ont chacune leur propre signature électrophysiologique permettant de les reconnaître dans l’espace.
Chaque structure de l’encéphale présente sa propre signature encéphalique. L’enregistrement électrophysiologique permet ainsi de repérer par un moyen non anatomique les cibles visées
La durée moyenne de l’intervention est de 7 à 8h.
La chirurgie peut se réaliser sous anesthésie locale, à l’aide d’un protocole spécifique de type « anesthésie générale, réveil per opératoire, suivi d’une sédation sous masque » en fin d’intervention dit « asleep, awake, asleep » afin d’améliorer le confort du patient ou encore sous anesthésie générale. Ce dernier protocole anesthésique rendant l’examen neurologique peropératoire servant à déterminer les effets bénéfiques de la chirurgie impossible.
*d. Première étape opératoire
Le premier temps opératoire va consister à l’implantation des Electrodes. Il se décompose en 5 étapes :
1) Mise en place du cadre de stéréotaxie et acquisition des images
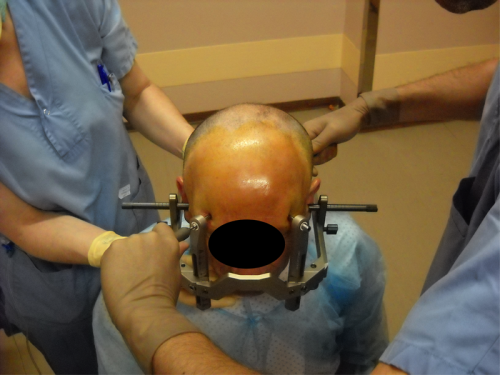
La mise en place du cadre de stéréotaxie est réalisée sous anesthésie locale. Il est parfois mis en place la veille de la chirurgie. Le cadre de stéréotaxie sert à la fois de référence lors de la réalisation de l’espace stéréotaxique (coordonnées des structures cérébrales du patient connues en x,y,z en fonction du cadre) mais également de moyen de contention permettant d’éviter les mouvements de la tête lors de l’acquisition des images et de la réalisation de la chirurgie.
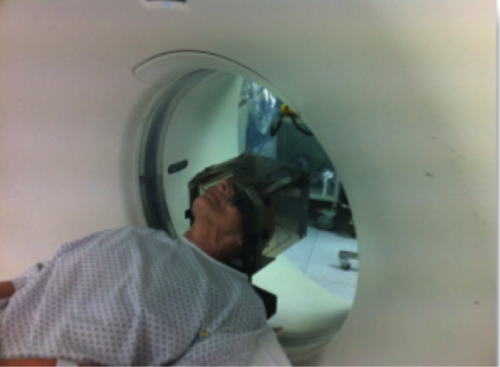
Le positionnement du cadre doit être réalisé de manière rigoureuse afin de permettre la visualisation des cibles. Le patient bénéficiera d’un scanner et/ou d’une IRM stéréotaxique, c’est-à dire avec cadre et boîte fiduciaire permettant de voir à l’imagerie les repères du cadre. _ Cette imagerie permettra au chirurgien d’être capable de déterminer dans les 3 plans de l’espace les coordonnées de chaque structure.
Le cadre doit être mis le plus possible suivant la ligne médiane et en respectant le plan Ca-Cp (un tilt important entraînera une asymétrie de l’image empêchant un calcul manuel de la position de la cible mais sera également préjudiciable lors des calculs à l’aide des navigateurs car le reformage de l’imagerie selon ces deux plans entraînera de facto une perte de résolution de contraste au niveau de l’imagerie).
Certaines équipes réalisent encore une ventriculographie, tandis que d’autres réalisent l’IRM sous anesthésie générale sans cadre et fusionnent cette image avec le scanner stéréotaxique.
Le cadre de Leksell® en place et est imagé avec sa boite fiduciaire lors de la réalisation des images (ici au scanner)
2) Planifications des trajectoires
Le neurochirurgien utilise différentes modalités d’imagerie afin de déterminer au mieux la cible stéréotaxique et les trajets pour atteindre cette cible.
Il s’agit d’une étape essentielle de la chirurgie.
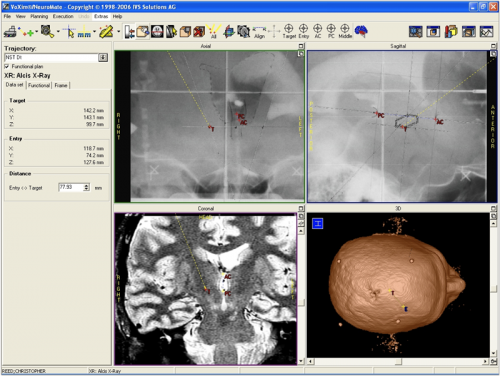
Historiquement, les cibles étaient déterminées de manière déjà très précise à partir de données statistiques fournies par différents atlas stéréotaxiques (Atlas de Talairach, Atlas de Schaltenbrand, ect.)9. Ces atlas permettent à partir de repères intracrâniens (la ligne bi-commissurale passant par la commissure blanche antérieure et commissure blanche postérieure formant la ligne dite Ca-Cp). A titre d’exemple, les coordonnées classiques du NST sont 12,5mm de latéralité / cette ligne, 4mm sous cette ligne et 11 mm en avant de CP. De plus en plus souvent ces repères sont utilisés pour se rapprocher de la cible et la visée se fera sur les données propres du patient à partir de séquences spécifiques en particulier IRM. Ces coordonnées sont encore utilisées lorsque la cible n’est pas visible en imagerie 3D IRM.
L’IRM permettra grâce aux séquences avec injection de gadolinium de voir les vaisseaux, sillons corticaux à éviter pour limiter le risque de saignements tandis que des séquences spécifiques (T2*, 3D Swan HR …) permettront de voir directement la cible.
L’avantage de l’IRM est ainsi la possibilité de s’adapter à l’anatomie propre du patient (obliquité taille latéralité du NST)4,37,19. L’imagerie IRM (si elle permet une bonne visualisation de la cible) permettra de planifier non pas un point mais bien une structure présentant un volume et des rapports spécifiques avec les autre tissus environnants. Il est alors possible de planifier la position au sein du noyau d’un ou plusieurs contacts de l’électrode définitive, de prendre en compte le volume et le positionnement de l’électrode / noyau.
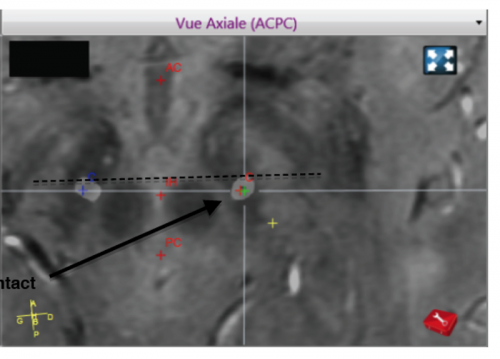
La cible (NST) est parfaitement visualisée sur cette séquence IRM 3D Swan dédiée
Cependant il s’agit d’une imagerie IRM soumise à des distorsions géométriques : l’objet (ou plus souvent la référence utilisée pour créer son espace stéréotaxique) n’est forcément pas vue à l’endroit exact où il se trouve ce qui peut impliquer une imprécision géométrique et un mauvais positionnement de l’électrode. C’est la raison pour laquelle le plus souvent les équipes utilisent d’autres protocoles d’imagerie non soumises à ces erreurs géométriques (scanner le plus souvent ou ventriculographie). Les données de l’IRM seront fusionnées avec les données du scanner ce qui permettra de limiter des erreurs de visée.
Des techniques pour limiter des distorsions en IRM sont également disponibles et permettent dans certains cas sur des IRM 1.5T l’utilisation de l’IRM seule(19).
Exemple de planification sur l’IRM et de fusion des images avec une ventriculographie. Si la ventriculographie était la méthode historique pour déterminer la cible, elle est aujourd’hui souvent remplacée par les imageries tels que l’IRM fusionnée (ou non) au scanner
Plus que la simple détermination d’une cible, la trajectoire planifiée a également une importance cruciale. Il sera nécessaire d’éviter vaisseaux, fonds de sillons épendyme pour limiter le risque hémorragique. Un trajet évitant de passer à travers les ventricules est indispensable car le shift entrainé par la perte de LCR sera tel que les repères déterminées en pré opératoire sur l’imagerie rendra l’information caduque. De même, Il apparaît nécessaire de planifier une trajectoire à distance des structures les plus fonctionnelles tels que la voie cortico-spinale etc(46,57,8).
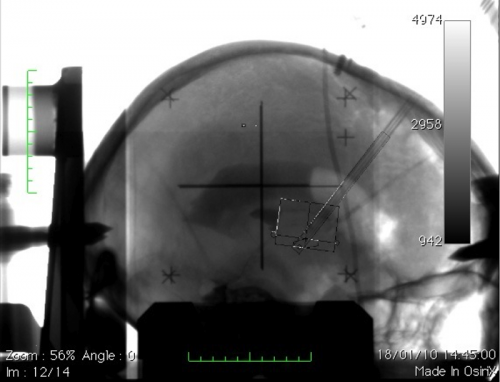
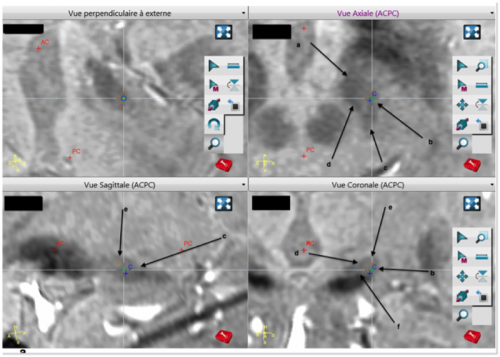
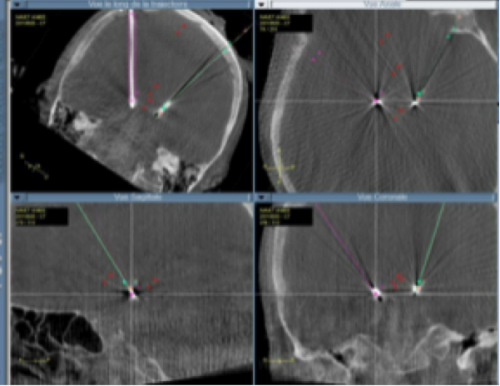
Exemple de planification de trajectoires pour une SCP-NST
3) Installation du malade
Après détermination de la cible finale, le patient est installé en décubitus dorsal, tête fixée par le cadre en position neutre ou discrètement surélevée par rapport au tronc. On déconseillera une position trop proclive de la tête afin de limiter le risque de pneumencéphalie.
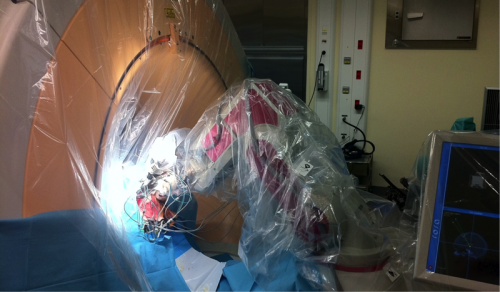
En cas d’utilisation d’un robot stéréotaxique, tout mouvement du cadre / robot doit pouvoir être proscrit. Les arcs utilisés communément avec les cadres de stéréotaxie ne présentent pas cette limite.
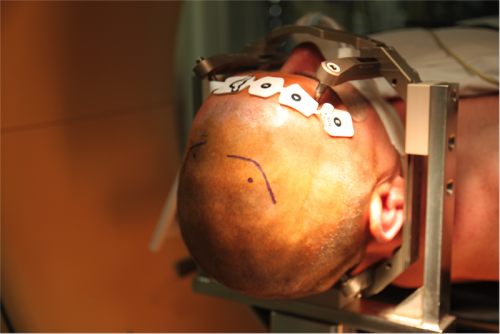
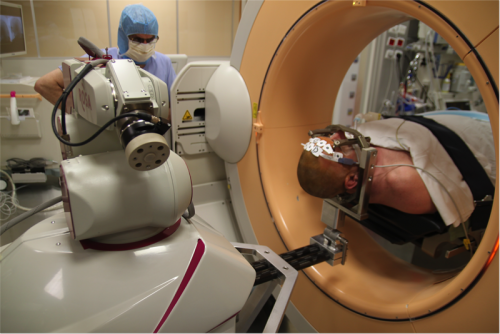
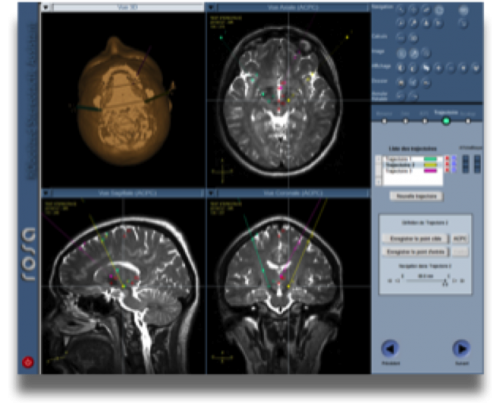
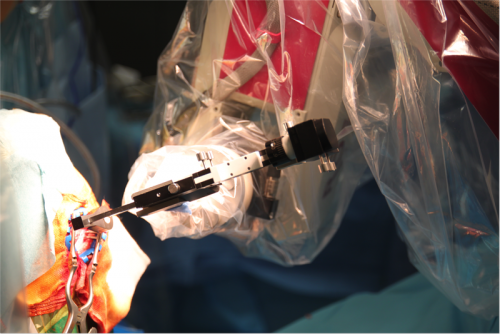
Exemple d’installation lors d’une utilisation du cadre, d’un robot et scanner peropératoire
On réalise alors les 2 scalps, les 2 trous de trépan en fonction de la planification du point d’entrée, coagulation de la dure mère dans le but de l’affiner sans permettre la perte LCR (toute perte massive de LCR sera responsable d’un important schift ne rendant plus adéquate le ciblage réalisé sur les données d’imagerie. Une perte importante de LCR pourra en outre être responsable d’une confusion post opératoire)
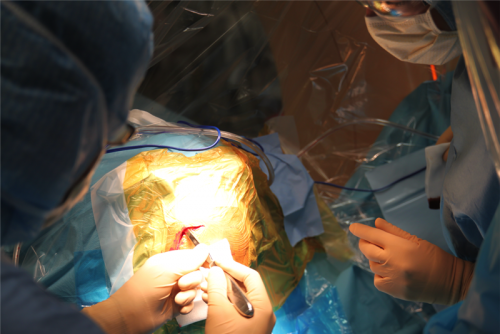
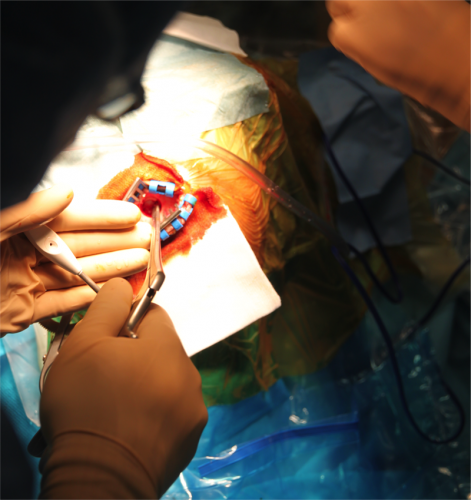
illustration des 2 scalps, du trou de trépan. La dure mère peut être affinée grâce à une pince bipolaire afin d’éviter la perte de LCR et la déviation des électrodes. Lorsque que l’on utilise des bouchons de fixations des électrodes dédiées (ex : stimlock®) la première partie du bouchon est posée à cette étape.
Mise en place du micro descendeur et des électrodes d’enregistrement. Il est à noter que des contrôles scanner per opératoires (téléradiographie / scanner / fpCT) permettront d’affirmer que ce qui a été planifié est bien ce qui est réalisé, et potentiellement de corriger les erreurs de positions des électrodes.
Le microdescendeur est en position, un tube guide en place. Une imagerie sera réalisée pour permettre de vérifier le bon positionnement de ce dernier par rapport à la trajectoire planifiée. Le robot stéréotaxique présentera alors l’avantage d’une correction facile du positionnement du micro-descendeur.
4) Descente des Electrodes d’enregistrement et enregistrements électrophysiologiques
Pour que la descente des électrodes puisse être réalisée, le patient doit être réveillé ou au minimum les agents anesthésiques diminués au maximum afin d’obtenir un enregistrement de qualité. Souvent 3 à 5 micro-électrodes sont descendues à l’aide d’un micro descendeur selon la trajectoire préalablement définie d’après les données anatomiques. Chaque structure encéphalique présente une signature électrique propre permettant de la différencier par son analyse fine.
Ces enregistrements permettent ainsi de déterminer électriquement la topographie du Noyau en profondeur et latéralité. Typiquement le NST (cible la plus utilisée) se caractérise par une activité de burst irrégulière (décharges toniques irrégulières) associée à un élargissement de la ligne de base29,7.

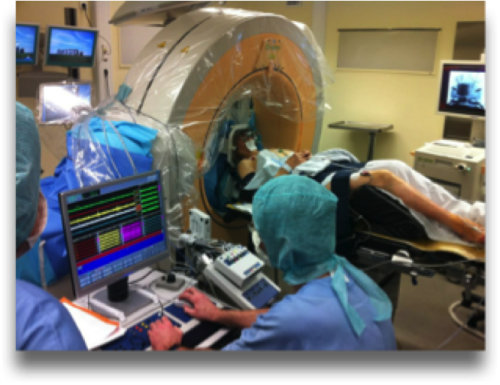
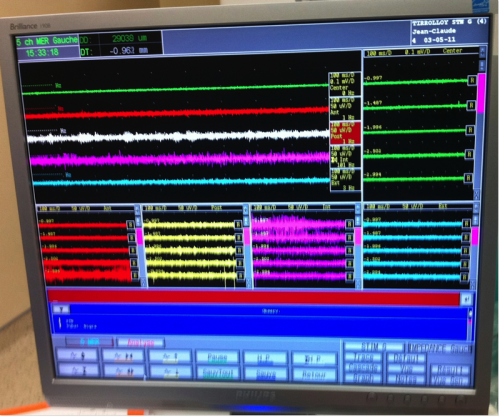
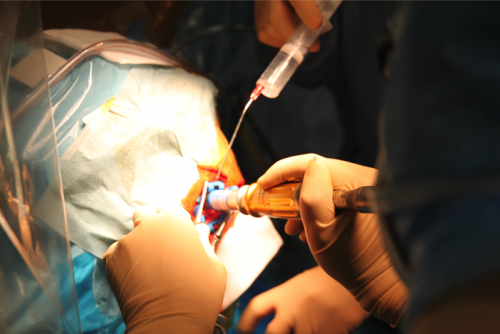
Illustrations des microélectrodes portées par le bras du robot stéréotaxique (gauche) et de l’enregistrement per opératoire réalisé par un neurophysiologiste expérimenté
Illustrations des différents paternes en fonction des structures traversées
5) Examen clinique neurologique peropératoire
En fonction des données anatomiques et électrophysiologiques sont déterminées les 2 ou 3 meilleures électrodes au sein du noyau. Est alors réalisé un examen clinique per opératoire (avec l’aide d’un neurologue expert en pathologie du mouvement) à l’aide des électrodes de stimulation dont le but est de reproduire les effets de la stimulation à haute fréquence.
Le but est de déterminer la meilleure électrode en évaluant le meilleur effet clinique sur la triade parkinsonienne (raison pour laquelle le traitement a été arrêté la veille) mais également de déterminer et d’éviter les effets indésirables liés au mauvais positionnement de l’électrode définitive47 (trop latérale en regard du faisceau cortico-spinal la stimulation sera responsable d’une contracture et ou d’une dysarthrie, trop postérieure responsable de paresthésies, trop médiale responsable de troubles oculomoteurs (fibre du III), ect.
Si le patient est opéré sous anesthésie générale seul le seuil de complications avec le faisceau cortico-spinal et la stimulation des fibres de la troisième paire crânienne sont déterminables (contracture tonique / déviation oculaire).
L’examen clinique per opératoire se fait en reprenant les paramètres de stimulation utilisés en post opératoire (haute fréquence : 130 Hz en particulier). Sous anesthésie générale, avec sédation au minimum, si des difficultés apparaissent pour différencier une diffusion au faisceau cortico-spinal de dyskinésies induites par la stimulation du NST, un stimulation basse fréquence peut alors être réalisée. Seul une diffusion aux voies motrice entraînera alors un mouvement.
Apport de l’examen clinique per opératoire
6) Mise en place de l’électrode définitive
Le choix de l’électrode définitive est le résultat d’une concertation pluridisciplinaire (neurochirurgien – neurophysiologiste – neurologue) dans le but d’obtenir le meilleur résultat clinique post opératoire.
Une fois ce choix réalisé, le chirurgien réalise l’implantation de l’électrode définitive selon les coordonnées déterminées précédemment. Les électrodes de détection/stimulation sont retirées. On implante alors l’électrode définitive selon les coordonnées décidées préalablement. L’imagerie per opératoire permet de vérifier le bon positionnement de l’électrode définitive.
L’électrode est alors fixée à la voûte du crâne en regard des trous de trépans via des capuchons dédiés, à l’aide de fils et de ciment ou de petites plaques d’ostéosynthèse suivant les choix du chirurgien.
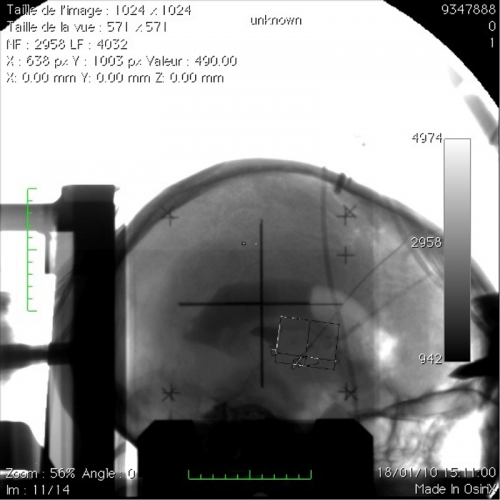
Illustration du contrôle per opératoire définitif. En haut, un scanner per opératoire permet de voir dans les 3D les électrodes et de s’assurer - après fusion avec le planning pré-opératoire – que l’électrode est bien en regard du NST. En bas, vérification du bon positionnement des électrodes sur les données de la téléradiographie (ventriculographie)
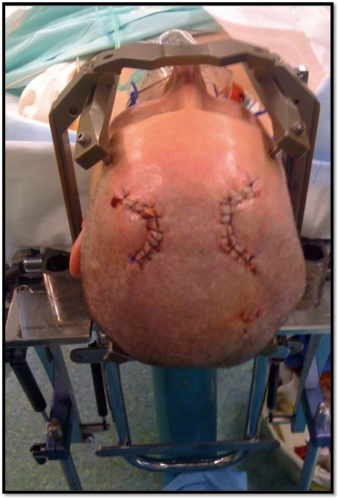
La même procédure sera réalisée pour le second coté, la procédure de SCP étant le plus souvent bilatérale. On vérifiera le bon positionnement des électrodes et détermination des coordonnées définitives des différents plots. Lorsque les deux électrodes définitives sont en place, le patient est le plus souvent re-sédaté par nos confrères anesthésistes (morphine +/- hypnovel®) afin de permettre une fermeture non douloureuse. Le patient est ventilé au masque. On tunnélise alors jusqu’en supra auriculaire les deux extensions extra -fixés sous la peau par un point au vicryl® 2.0. Les deux scalps seront refermés en deux plans (Vicryl® 2.0 ou équivalent pour la peau et Ethilon® 2.0 ou équivalent pour la peau).
Seuls 2 petits scalps sont nécessaire pour insérer les électrodes.
Après fermeture des scalps, le patient sera adressé pour 24 heures en surveillance continue neurochirurgicale comme tout patient opéré d’un crâne. On reprendra l’ensemble des médications anti parkinsoniennes le soir même.
Il est à noter qu’avec l’amélioration de la détermination de la cible sur l’imagerie IRM, l’évolution est vers une simplification de la technique. Le réveil per opératoire est moins systématique, la cible étant mieux définie les chirurgiens peuvent également se permettre d’utiliser moins de micro-électrodes en per opératoire dans le principal but de raccourcir le temps opératoire, d’améliorer le confort du patient mais également de diminuer le risque hémorragique.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica