 Métastases cérébrales
Métastases cérébrales
VI. Diagnostic
6.1. Diagnostic clinique
Les signes cliniques faisant évoquer un diagnostic de MC ne sont pas spécifiques de l’origine du cancer primitif. La présence de l’un des signes cliniques décrits ci-dessous doit rapidement mener à la réalisation d’une imagerie cérébrale.
• Les céphalées et l’hypertension intracrânienne (HIC)
L’apparition de céphalées, qui constituent l’un des signes les plus précoces de l’HIC, chez un patient atteint de cancer doit rapidement faire rechercher la présence de MC. Les céphalées sont présentes initialement dans 40 à 50 % des cas de MC (21) et n’ont pas de caractère spécifique. Elles sont parfois accompagnées de nausées ou de troubles de la vigilance pouvant aller jusqu’au coma (12). L’HIC peut être secondaire à plusieurs mécanismes isolés ou associés :
- l’effet de masse lié au volume tumoral
- l’œdème vasogénique péritumoral
- l’hydrocéphalie obstructive (métastase de la fosse postérieure) • L’épilepsie
La crise d’épilepsie est révélatrice de la présence de MC dans 20% des cas (33). Elle peut être simple ou complexe, partielle ou secondairement généralisée. La localisation sous-corticale fréquente des MC peut expliquer leur caractère épileptogène. Le type de crise peut parfois aider à orienter la localisation cérébrale des MC : frontale (crise motrice), pré-rolandique (crise Bravais-jacksonienne), pariétale (crise sensitive ou vertigineuse), occipitale (crise visuelle), temporale (hallucinations auditives) ou fronto-temporales (troubles phasiques).
• Le déficit neurologique focal
Les signes neurologiques focaux sont présents au moment du diagnostic chez 40% des patients atteints de MC (62). Une hémiparésie, une aphasie ou des troubles visuels comme une hémianopsie latérale homonyme sont classiquement observés. Ces symptômes peuvent être liés à l’effet de masse de la MC ou à l’œdème péri lésionnel évoluant progressivement en « tache d’huile ». Leur survenue peut également être brutale, mimant ainsi un accident vasculaire cérébral transitoire ou constitué lors d’un saignement intra-tumoral (55).
• Les troubles cognitifs
Les troubles cognitifs doivent être recherchés chez les patients atteints de MC car ils touchent 65% de ces patients avant traitement (39). Souvent sous-estimés, ils peuvent être associés à une atteinte dysexécutive ou à des troubles mnésiques, mais aussi altérer la qualité de vie de ces patients. Les troubles liés à l’HIC, les syndromes frontaux ou les signes d’atteinte du lobe temporal non dominant sont particulièrement pourvoyeurs de troubles cognitifs.
6.2. Diagnostic par imagerie des MC
• Scanner
Le scanner cérébral est en général le premier examen réalisé du fait de sa facilité d’accès en urgence. Les MC ont une densité proche de celle du parenchyme cérébral mais peuvent néanmoins apparaître hypo ou hyperdense (44). Une hyperdensité spontanée peut être observée en cas de MC hémorragique ou en raison d’une densité cellulaire élevée (mélanome). La prise de contraste est en général bien délimité et homogène ou annulaire. Une hypodensité centrale est objectivée en cas de nécrose. L’œdème péri tumoral apparaît hypodense. Le bilan d’imagerie doit systématiquement être complété par une IRM cérébrale.
• IRM
L’IRM cérébrale avec injection de gadolinium est l’examen de référence du fait de sa sensibilité plus grande par rapport au scanner (57). Elle permet ainsi de faire le diagnostic de MC multiples là où le scanner injecté ne retrouvait qu’une lésion unique chez 19% des patients (57). L’IRM est particulièrement utile pour le diagnostic des lésions de la fosse postérieure, des lésions de petite taille (3mm) (29) ou des lésions méningées.
Les caractéristiques des MC en IRM restent peu spécifiques. Elles apparaissent en isosignal avec la substance grise sur les séquences pondérées en T1, et en hypersignal avec l’œdème péritumoral les entourant sur les séquences pondérées T2 ou T2 FLAIR. L’injection de gadolinium entraine un rehaussement homogène ou annulaire périphérique selon l’absence ou la présence de nécrose intra tumorale. L’IRM multimodale doit faire partie du bilan pré-thérapeutique des MC. Les séquences de diffusion et le coefficient apparent de diffusion (ADC) doivent être réalisés. Le signal observé sur ces séquences est dépendant du cancer primitif (18). La diffusion est utile pour différencier une MC d’un abcès cérébral, les MC apparaissant hyperintense sur les séquences de diffusion. L’IRM de perfusion permet d’évaluer le volume sanguin cérébral relatif (rCBV) de la tumeur pour le comparer à celui des autres régions du cerveau (cerveau sain). Cette séquence permet d’évaluer la présence d’une néoangiogenèse tumorale et peut aider à différencier une MC d’une tumeur gliale de haut grade ou d’un lymphome cérébral primitif (18). La spectroscopie permet également d’orienter vers le diagnostic de MC grâce aux informations qu’elle fournit sur les métabolites de la tumeur. L’association d’un pic de lipide et de choline, l’augmentation du taux de lactates sont retrouvés en cas de nécrose au sein des MC (34). Les principales séquences IRM utilisées sont présentées dans la figure 1.
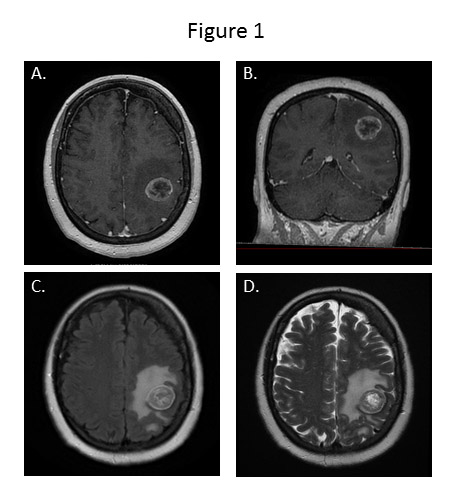
- Différentes séquences IRM d’une métastase pariétale gauche d’un adénocarcinome mammaire
- Différentes séquences IRM d’une métastase pariétale gauche d’un adénocarcinome mammaire : lésion tumorale siège d’une importante néo-angiogenèse, entouré d’un important œdème réactionnel.
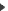 Séquence axiale (A) et coronale (B) T1 après injection de Gadolinium
Séquence axiale (A) et coronale (B) T1 après injection de Gadolinium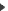 Séquence axiale T2 FLAIR (C)
Séquence axiale T2 FLAIR (C)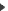 Séquence axiale T2 FSE (D)
Séquence axiale T2 FSE (D)
Le développement de nouvelles techniques chirurgicales comme la microchirurgie en neuronavigation ou la chirurgie éveillée nécessite la réalisation de séquences IRM particulières. Les séquences 3D T1 avec injection de gadolinium permettent de détecter les lésions profondes ou de petites tailles, et constituent pour le neurochirurgien une aide peropératoire pour l’utilisation du système de navigation. L’IRM par tenseur de diffusion (DTI) permet de visualiser le trajet des fibres blanches, tels que le faisceau cortico-spinal ou le faisceau arqué, ainsi que leur réarrangement lié à la présence de la MC (13). L’IRM fonctionnelle (IRMf) permet de réaliser une cartographie virtuelle des zones corticales fonctionnelles. Elle aide le neurochirurgien à préparer son intervention sans remplacer pour autant la cartographie corticale peropératoire en cas de chirurgie éveillée en zone éloquente.
La multiplicité des lésions, leur localisation à la jonction substance grise-substance blanche ou la présence d’un œdème important sont des arguments radiologiques supplémentaires pour le diagnostic de MC. Toutefois, aucune de ces séquences d’imagerie ne permet de faire le diagnostic de MC avec certitude. La confirmation histologique est indispensable.
6.3. Diagnostic histologique et moléculaire
Afin de permettre au pathologiste de faire le diagnostic, il est impératif de lui transmettre les données cliniques (âge, antécédents médicaux, ...), biologiques et radiologiques du patient (7).
• Analyses histologiques
Les MC présentent classiquement les caractéristiques de la tumeur primitive tant sur les analyses histologiques que sur les analyses immuno-histochimiques.
En fonction de l’origine du primitif, les MC peuvent être de différents types : adénocarcinome, carcinome épidermoïde, carcinome à petites ou à grandes cellules avec différenciation neuroendocrine ou carcinome non à petites cellules. L’objectif pour le pathologiste est de déterminer le type carcinome qui est responsable de la formation de MC histologique de la tumeur primitive responsable du développement des MC.
En présence d’un adénocarcinome sans cancer primitif connu, les analyses immuno-histochimiques (IHC) sont utiles pour orienter et déterminer l’origine de la tumeur primitive (36). Les analyses doivent d’abord rechercher une origine broncho-pulmonaire en détectant la présence des anticorps TTF1 (thyroïde transcription factor), CK7 (Cytokine) et CK20 (36, 7). La protéine TTF1 est exprimée par 80 % des adénocarcinomes pulmonaires non mucineux mais également par les carcinomes thyroïdiens voire mammaires (66). Une MC d’adénocarcinome exprimant TTF1 doit faire réaliser systématiquement et sans délai les analyses moléculaires selon les critères définis par l’Institut National du Cancer (INCa) en 2011 et détaillés dans le chapitre suivant. Lorsque TTF1 n’est pas exprimée, l’analyse de l’expression de CK20 et de CDX2 doit être réalisée afin d’orienter vers une origine colorectale (56).
Les carcinomes épidermoïdes sont assez typiques en analyse optique conventionnelle mais lorsqu’ils sont peu différenciés, la recherche de l’expression de CK5/6, CK34βE12 ou p40 peut être nécessaire pour confronter une différenciation épidermoïde (30, 53).
Lorsqu’une MC est suspectée être d’origine mammaire, l’expression d’HER 2 et la présence de récepteurs hormonaux doivent être recherchés en raison de leur impact thérapeutique (52).
• Analyses moléculaires
L’analyse des marqueurs moléculaires fait désormais partie des examens recommandés par l’INCa afin de permettre l’accès aux thérapies ciblées (site de l’INCA :
http://www.e-cancer.fr/soins/les-traitements/lacces-aux-therapies-ciblees/un-programme-pour-faciliter-lacces-aux-therapies-ciblees). Ces analyses doivent être réalisées sur les MC même lorsqu’elles ont été réalisées au préalable sur la tumeur primitive. En effet, une différence d’expression, entre la tumeur primitive et la MC, de certains biomarqueurs comme HER2 est possible (52). Les biomarqueurs à rechercher dépendent du cancer primitif :
![]() En cas de MC de cancer broncho-pulmonaire, les mutations des gènes BRAF et EGFR et les réarrangements des gènes ALK er ROS1 seront recherchés.
En cas de MC de cancer broncho-pulmonaire, les mutations des gènes BRAF et EGFR et les réarrangements des gènes ALK er ROS1 seront recherchés.
![]() En cas de MC de cancer du sein, l’amplification du gène HER 2 sera recherchée.
En cas de MC de cancer du sein, l’amplification du gène HER 2 sera recherchée.
![]() En cas de MC de cancer colorectal, la mutation du gène KRAS sera recherchée.
En cas de MC de cancer colorectal, la mutation du gène KRAS sera recherchée.
![]() En cas de MC de mélanome, la mutation du gène BRAF 600 sera recherchée.
En cas de MC de mélanome, la mutation du gène BRAF 600 sera recherchée.
 Encyclopædia Neurochirurgica
Encyclopædia Neurochirurgica

